Olimpiade Sains Kota (OSK) 2014 - Kimia
Analisis unsur suatu asam menunjukkan bahwa persen massa unsur penyusun molekul asam tersebut adalah 5,89% H, 70,6% C, dan 23,5% O. Bila berat molekul asam tersebut adalah 136 g/mol, bagaimana formula molekulnya?
A. C6H16O3
B. C7H4O3
C. C8H8O2
D. C9H12O
E. C9H16O
Untuk mendapatkan gas nitrogen dioksida (NO2), anda mereaksikan dua gas tak dikenal (gas A dan B). Dengan menggunakan data yang anda peroleh, anda dapat menuliskan persamaan reaksi setara sebagai berikut:
2A(g) + B(g) → 2NO2(g)
Bila anda mulai dengan 8 L gas A dan 3 L gas B, Berapa liter gas NO2 yang akan anda peroleh ? (anggaplah semuanya dalam keadaan s.t.p.)
A. 2 L
B. 3 L
C. 4 L
D. 6 L
E. 8 L
10 g parafin, C20H42, suatu zat terlarut yang tak mudah menguap, dilarutkan dalam 50 g benzena, C6H6. Pada suhu 53°C, tekanan uap murni benzena adalah 300 torr. Tekanan uap Iarutan pada suhu tersebut adalah ...
A. 298 torr
B. 292 torr
C. 284 torr
D. 275 torr
E. 267 torr
Larutan pekat asam klorida, HCI, adalah Iarutan 36% w/w HCI dalam air. Larutan ini memiliki rapat massa 1,18 g/cm3. Konsentrasi Iarutan tersebut adalah ...
A. 1,2 M .
B. 12 M
C. 24 M
D. 30 M
E. 7 M
Molalitas senyawa para-diklorobenzena (C6H4Cl2) dalam suatu Iarutan yang dibuat ndengan cara melarutkan 2,65 g C6H4CI2 dalam 50mL benzena (kerapatan = 0,879 g/mL) adalah:
A. 0,018 m
B. 0,041 m
C. 0,180 m
D. 0,410 m
E. 1,810 m
Dengan menggunakan data berikut ini:
| N2(g) + 3O2(g) + H2(g) |
|
| N2O5(g) + H2O(g) |
|
| 2H2O(g) |
Tentukan H untuk reaksi:
N2O5(g) N2(g) + 5O2(g)
A. 149,6 kJ
B. 90,8 kJ
C. –876,4 kJ
D. 782,8 kJ
E. 1750 kJ
Suatu isotop atom 23Mg mempunyai muatan +2. Jumlah proton, neutron, dan elektron yang dimilikinya adalah:
| Jumlah Proton | Jumlah Neutron | Jumlah Elektron | |
| A | 12 | 13 | 10 |
| B | 12 | 11 | 11 |
| C | 12 | 11 | 10 |
| D | 10 | 13 | 11 |
| E | 10 | 11 | 12 |
Berikut ini pereaksi manakah bila dicampur dan dipanaskan dengan amonium sulfat membebaskan amonia?
A. Akua bromin
B. Asam hidroklorida encer
C. Air kapur
D. Asam nitrit
E. Kalium dikromat (VI) diasamkan
Mengenai ion Fe+3 , manakah konfigurasi elektron boks dari sub–kulit 3d yang benar?
| A. | |||||
| B. | |||||
| C. | |||||
| D. | |||||
| E. |
Atom–atom berikut ini, manakah yang mempunyai energi ionisasi kedua yang paling besar?
A. Al
B. Mg
C. Ca
D. Ti
E. Na
Jumlah elektron valensi yang terdapat dalam ion oksalat, C2O42– adalah ...
A. 2
B. 10
C. 32
D. 34
E. 44
Dari persamaan berikut ini, manakah yang merupakan reaksi oksidasi–reduksi?
A. 2HCl(aq) + Mg(s) → MgCl2(aq) + H2(g)
B. Na2O(s) + H2O(l) → 2NaOH(aq)
C. CO2(g) + H2O(l) → H2CO3(aq)
D. CaO(s) + SO3(g) → CaSO4(s)
E. NH3(g) + HCl(g) → NH4Cl(s)
Dari pernyataan berikut ini, manakah pernyataan yang benar untuk menjelaskan sifat–sifat yang dikaitkan dengan ikatan ionik dan kovalen?
A. Senyawa kovalen tidak dapat membentuk suatu elektrolit.
B. Senyawa kovalen dengan titik leleh tinggi hanya terjadi bila terdapat ikatan hidrogen.
C. Beberapa senyawa kovalen yang mengandung oksigen dan hidrogen dalam molekulnya dapat membentuk ikatan hidrogen.
D. Ikatan ionik dan ikatan kovalen keduanya tidak dapat terjadi dalam suatu senyawa yang sama.
E. Senyawa ionik berbeda dari logam di mana senyawa ionik tidak menghantarkan listrik dalam keadaan padat
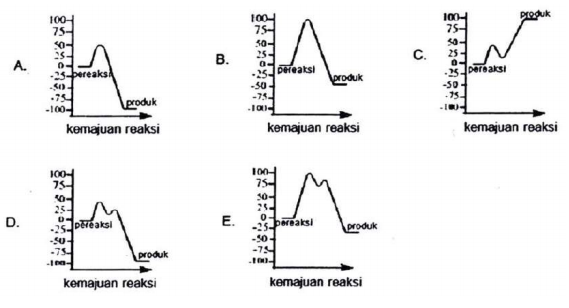
Suatu reaksi kimia eksotermik berlangsung dalam dua tahap reaksi,
Pereaksi Intermediet
Produk
Energi aktivasi tahap 1 adalah 50 kJ.mol–1 , sedangkan perubahan entalpi reaksi keseluruhan adalah –100 kJ.mol–1 . Berdasarkan data tersebut, manakah diagram yang menggambarkan diagram tingkat energi untuk reaksi ini?
Arus listrik 0,0965 A dialirkan ke dalam 50 mL larutan NaCl 0,1 M selama 1000 detik, maka konsentrasi OH– dalam larutan adalah ...
A. 0,0005 M
B. 0,0010 M
C. 0,0020 M
D. 0,0100 M
E. 0,0200 M
Elektrolisis larutan CuSO4 dengan elektroda platina menggunakan arus 1 A selama 965 detik. Berat Cu yang mengendap pada katoda adalah
A. 3,175 g
B. 0,03175 g
C. 0,0635 g
D. 0,3175 g
E. 31,75 g
Suatu gas senyawa organik, X, dibakar dengan oksigen berlebih. Sebanyak 0,112 dm3 sampel X diukur pada s.t.p., menghasilkan 0,88 karbon dioksida. Berapa banyak atom karbon yang terdapat dalam satu molekul senyawa X ini?
A. 1
B. 2
C. 3
D. 4
E. 8
Senyawa berikut ini, manakah yang mempunyai titik didih paling tinggi?
A. CH3CH2CH2CH2CH2CH3
B. CH3CH2OH
C. CH3CH2CH(OH)CH3
D. CH3CH2(CH2)2CHO
E. CH3(CH2)5OH
Dari kelima senyawa organik tersebut di bawah ini, manakah yang paling benar tata namanya?
A. 2–kloro–5–metil–5–heksena
B. 2–metil–1–pentena–4–ol
C. 3–etil–2–metil–2–pentena
D. 2–metil–2–heksana–4–ol
E. 2,3–dimetilsikloheksena
Senyawa radikal bebas di bawah ini manakah yang paling stabil?
A. CH3 •
B. (CH3)2CH •
C. (CH3)3C •
D. C2H5 •
E. (CH3)2CHCH2 •
Tentukan urutan kereaktifan dari senyawa turunan asam karboksilat berikut:
- Asetamida
- Asetil klorida
- Etil asetat
- Anhidrida asam asetat
A. 1 > 2 > 3 > 4
B. 2 > 1 > 3 > 4
C. 3 > 4 > 2 > 1
D. 2 > 4 > 3 > 1
E. 4 > 3 > 2 > 1
Semua senyawa berikut adalah merupakan isomer dari butanon, kecuali?
A. t–butileter
B. Tetrahidrofuran
C. 2,3–epoksibutan
D. Etilvinyl eter
E. 1,2–butenol
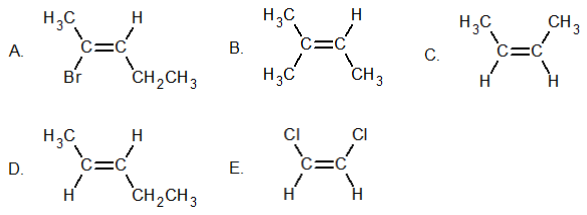
Manakah dari senyawa berikut yang tidak menunjukkan isomer cis–trans?
Dengan menggunakan pereaksi Grignard, di bawah ini senyawa mamah yang dapat menghasilkan CH3CH2CH(OH)CH2CH3?
A. Metil etilketon dan metil Grigdnard
B. Propanon dan metil Grignard
C. Butil Grignard dan asetaldehida
D. Etil Grignard dan propionaldehida
E. Krotonaldehida dan etil Grignard
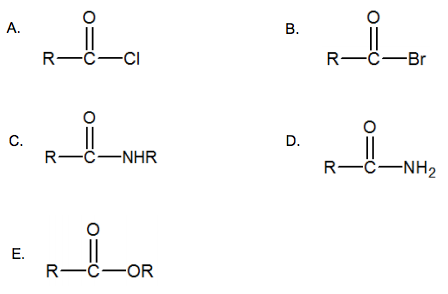
Reaksi esterifikasi asam karboksilat dengan alkil halida dalam suasana basa akan menghasilkan produk akhir adalah:
Ada dua senyawa wujudnya gas, terbuat dari unsur X dan Y. Senyawa A mengandung 30,43% X dan 69,57% Y (%massa). Pada keadaan standar unsur X dan Y memiliki wujud gas namun Anda harus memperkirakan apakah gas–gas tersebut mono–atomik, di–atomik atau tri–atomik. Pada suhu tertentu 1 volum gas X dapat bereaksi dengan 2 volum gas Y membentuk 2 volum senyawa A. Jika 2 volume gas X bereaksi dengan 1 volum gas Y membentuk 2 volum senyawa B.
- Hitung perbandingan massa atom X terhadap Y!
- Perkirakan rumus sesungguhnya gas X dan Y!
- Tuliskan persamaan reaksi yang mungkin untuk terbentuknya senyawa A dan B!
Suatu wadah bervolum 2,125 L berisi gas belerang dioksida, dengan tekanan 0,75 atm pada 80 oC dihubungkan dengan pipa berkeran ke wadah lain berukuran 1,5 L berisi gas oksigen bertekanan 0,5 atm pada suhu yang sama.
- Hitung fraksi mol gas belerang dioksida ketika kedua gas dicampurkan dengan membuka keran pipa penghubung kedua wadah (asumsikan kedua gas itu tidak bereaksi dan volum pipa penghubung kedua wadah tersebut dapat diabaikan)
- Tentukan tekanan total setelah pencampuran gas dalam wadah tersebut
- Hitung tekanan parsial gas belerang dioksida, setelah pencampuran tersebut
- Jika dalam wadah tersebut terdapat katalis sehingga campuran gas bereaksi membentuk gas belerang trioksida, hitunglah fraksi mol gas belerang dioksida yang masih tersisa setelah terjadi reaksi sempurna
- Hitung pula tekanan total setelah reaksi berlangsung sempurna
- Menurut Teori Kinetik Gas, tekanan gas secara molekuler sebanding dengan akar kecepatan kuadrat rata–rata (rms = rootmean square). Kecepatan rms, vrms diberikan oleh persamaan berikut:
Tentukan vrms dalam m/s molekul gas belerang dioksida pada suhu 80 oC
- Tentukan volum gas belerang dioksida, SO2, yang berefusi pada saat 0,50 cm3 belerang trioksida (telah berefusi keluar dari wadah tersebut)
Barium peroksida dapat dibuat dari reaksi kesetimbangan barium oksida dengan oksigen pada tekanan dan temperatur tertentu. Sebanyak 1 g sampel yang mengandung campuran barium oksida dan barium peroksida direaksikan dengan asam sulfat, terbentuk 1,49 g endapan putih yang dipisahkan dari filtratnya. Filtrat tersebut dapat bereaksi dengan kalium iodida dalam asam menghasilkan 1,18 x 10–3 mol iodin.
a. Tuliskan persamaan reaksi pembuatan barium peroksida
b. Tuliskan persamaan reaksi–reaksi yang mungkin terjadi antara sampel di atas dengan asam sulfat
c. Tuliskan pula persamaan reaksi filtrat dengan kalium iodida dalam asam
d. Bagaimana cara praktis mengetahui jumlah iodida yang dihasilkan pada reaksi tersebut? Tuliskan persamaan reaksi selengkapnya.
e. Hitung persen massa oksida–oksida yang terkandung dalam sampel tersebut
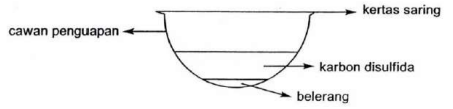
Karbon disulfida, CS2, pada suhu 46 oC merupakan pelarut yang sangat baik untuk melarutkan belerang dan senyawa lainnya. Namun penggunaan senyawa ini di laboratorium sudah mulai dikurangi karena beracun dan sangat mudah terbakar.
a. Gambar berikut menunjukkan cara untuk membuat salah satu alotrop dari belerang.
i. Gambarkan struktur Lewis karbon disulfida dan tuliskan bentuk geometrinya.
ii. Tuliskan rumus molekul dan gambar struktur suatu alotrop molekul belerang.
iii. Jelaskan mengapa belerang dapat larut dalam karbon disulfida
b. Salah satu bahaya dalam penggunaan karbon disulfida adalah bahwa senyawa tersebut sangat cepat menyala dan terbakar ketika berkontak dengan udara sesuai reaksi berikut (belum setara): CS2(l) + O2(g) CO2(g) + SO2(g)
i. Setarakan persamaan reaksi di atas.
ii. Hitung volum total gas yang dihasilkan (pada 20 oC dan 1 atm) jika sebanyak 25 mL karbon disulfida cair dibakar sempurna. Diketahui kerapatan karbon disulfida adalah 1,26 g/mL pada 20 oC.
iii. Hitung massa gas CO2 dan SO2 (dalam gram) yang dihasilkan pada reaksi dalam soal (b.ii)
c. Dalam proses ekstraksi dikenal suatu tetapan yang disebut koefisien partisi, Kd, yaitu perbandingan antara konsentrasi zat terlarut dalam pelarut pada fasa bagian atas terhadap konsentrasi zat terlarut dalam pelarut pada fasa bagian bawah. Satuan konsentrasi yang lain digunakan adalah g zat terlarut/mL pelarut. Koefisien partisi Kd untuk iod (I2) dalam pelarut air dan karbon disulfida pada 20 oC adalah 2,4 x 10–3 . Diketahui kerapatan air adalah 1,00 g/mL dan kerapatan karbon disulfida adalah 1,26 g/mL pada suhu 20 oC. Sebanyak 100 mL sampel larutan ion dalam air dengan konsentrasi 5,0 x 10–4 M diekstraksi dengan 20 mL karbon disulfida.
i. Tuliskan ungkapan Kd untuk ion dalam soal di atas.
ii. Hitung massa iod yang dapat diekstraksi oleh karbon disulfida.
iii. Jelaskan mana kelarutan iod yang lebih besar, apakah dalam air atau dalam karbon disulfida?
Bahan plastik dapat dilapisi oleh krom dengan cara:
i. Pertama, melapiskan lapisan tipis pasta grafit pada plastik,
ii. Kemudian plastik yang dilapisi pasti grafit ditempatkannya dalam bath dari akua krom(III)sulfat
iii. Kemudian dilakukan elektroplating (proses pelapisan logam)
Berdasarkan proses tersebut:
(a) Berikan alasan mengapa sebelum dilapisi krom, bahan plastik ini harus dilapisi dengan pasta grafit
(b) Untuk dapat dilapisi krom, zat apakah yang dapat digunakan untuk elektroda lain dalam sel elektroplating?
(c) Gambarkan suatu diagram sirkuit listrik untuk proses elektroplating.
(d) Jika suatu arus 0,50 A dilewatkan melalui sel selama 300 detik, berapa bertambahnya massa karena pelapisan krom ini?
(e) Dengan metode ini, mengapa tidak mungkin melapisi bahan plastik dengan Zn bila digunakan larutan Zn2+ sebagai elektrolit?